
Produits & Réglementation
Le saviez-vous ?
Pourquoi nos grand-mères conseillent-elles de manger des yaourts ?
Dans le temps, nos grands-mères et notre médecin de famille conseillaient de manger des yaourts lors d'un traitement aux antibiotiques. En effet, les antibiotiques détruisent la flore intestinale et peuvent ainsi causer des maux de ventre. Les ferments du yaourt sont une aide précieuse afin de...
Les nouveaux ingrédients (novel food)
Chaque année, des milliers de nouveaux produits sont mis sur le marché. Ce sont pour la plupart des modifications de « recettes ». Exemple : Un nouveau fourrage pour une barre chocolatée.
D'autres aliments n'ont eux jamais fait l'objet d'une consommation au sein des pays de l'Union européenne. Ils sont en général le fruit du progrès technique et des connaissances scientifiques : recherche nutritionnelle, procédés de fabrication innovants... Il peut aussi s'agir d'aliments exotiques, nouveaux pour le marché européen.
On parle de « novel food ». Quelques exemples : graines de Chia, jus de noni, huile extraite de microalgue, bêta-glucanes de levures, phytostérols.
Les novel food sont souvent utilisés dans les aliments enrichis en nutriments, les compléments alimentaires...
Afin de s'assurer de leur sécurité, ils sont soumis, depuis 1997 à une procédure d'autorisation, passage obligé avant de pouvoir être commercialisé.
DEFINITIONS
De 1997 à 2018, comment étaient définis les « novel food » ?
En 1997, le règlement 258/97 a défini les nouveaux aliments, dit « novel food ».
Un novel food répondait à deux conditions cumulatives :
- une consommation négligeable dans l'Union européenne avant le 15 mai 1997.
Et
- l'appartenance à l'une des quatre catégories suivantes :
- ingrédient avec une structure moléculaire primaire nouvelle (ex : D-Tagatose)
- ingrédient composé ou isolé de micro-organismes, de champignons ou d'algues (ex : bêta-glucanes de levures, Chitine-glucane issu d'Aspergillus niger)
- ingrédient composé ou isolé de végétaux ou d'animaux (ex : pulpe déshydratée de fruit de baobab; extrait de haricot noir (de soja); oléorésine de lycopène extrait de tomate; protéines de pommes de terre coagulées)
- ingrédient auquel a été appliqué un procédé de production innovant qui entraîne des modifications de l'ingrédient (ex : levure traitée aux U enrichie en vitamines D, préparations de fruits pasteurisées au moyen d'un traitement de hautes pressions, extrait de Magniola par CO2 supercritique)
Est-ce qu'il y a des exemptions à la définition ?
Certaines catégories d'ingrédients sont déjà réglementées. Le législateur européen a considéré que les niveaux de sécurité apportés par ces réglementations spécifiques sont équivalents à ceux du règlement 258/97. Ils sont exclus du champ d'application du règlement « novel food » : les additifs alimentaires, les arômes alimentaires, les enzymes alimentaires et les solvants d'extraction.
Comment savoir si la consommation d'un aliment était significative avant le 15 mai 1997 ?
La Commission européenne a publié un guide pour aider les entreprises à déterminer si la consommation de leur aliment était significative ou non avant le 15 mai 1997 :
Lien vers le guide
Un autre outil est le catalogue novel food :
Lien vers le catalogue
Un aliment dont la consommation était négligeable avant 1997 est-il nécessairement un novel food ?
Il existe deux critères cumulatifs pour qu'un produit soit considéré comme novel food : avoir une consommation négligeable avant 1997 et appartenir à l'une des 4 catégories citées ci-dessus.
Ainsi un seul de ces deux critères n'est pas suffisant pour qualifier un aliment de novel food.
C'est le cas des aliments ou ingrédients dont la consommation était négligeable avant le 15 mai 1997 et qui n'appartiennent pas à l'une des 4 catégories. Ex : Nouvelle recette.
Un aliment qui correspond à l'une des dix catégories est-il nécessairement un novel food ?
Il existe deux critères cumulatifs pour qu'un produit soit considéré comme novel food : avoir une consommation négligeable avant 1997 et appartenir à l'une des catégories d'aliments "novel food" définies.
Un seul de ces deux critères n'est pas suffisant pour qualifier un aliment de novel food.
Ex : La farine de blé est composé de végétaux mais fait l'objet d'une consommation significative depuis plusieurs siècles. Elle n'est donc pas novel food.
Depuis le 1er janvier 2018, quelle est la définition actuelle d'un « novel food » ?
Depuis le 1er janvier 2018, le règlement 2015/2285 s'applique. Il définit les nouveaux aliments, dit « novel food ».
Un novel food répond à deux conditions cumulatives :
- une consommation négligeable dans l'Union européenne avant le 15 mai 1997
Et
- l'appartenance à l'une des dix catégories suivantes :
- Ingrédient avec une structure moléculaire nouvelle ou délibérément modifiée
- Ingrédient qui se compose, est isolé ou produit à partir de micro-organismes, de champignons ou d'algues
-
Ingrédient qui se compose, est isolé ou produit à partir de :
- matériaux d'origine minérale
- végétaux ou de parties de végétaux
- animaux ou de leurs parties
- cultures cellulaires ou tissulaires dérivées d'animaux, de végétaux, de micro-organismes, de champignons ou d'algues
- Ingrédient résultant d'un nouveau procédé de production qui entraîne des modifications significatives dans la composition ou la structure de l'ingrédient
- Ingrédient qui se compose de nanomatériaux manufacturés
- Vitamines, minéraux et autres substances résultant d'un nouveau procédé de production ou constitués de nanomatériaux
- Ingrédient utilisé exclusivement dans les compléments alimentaires avant le 15 mai 1997
PROCEDURE D'AUTORISATION
De 1997 à 2018 : une procédure d'autorisation décentralisée et souvent longue
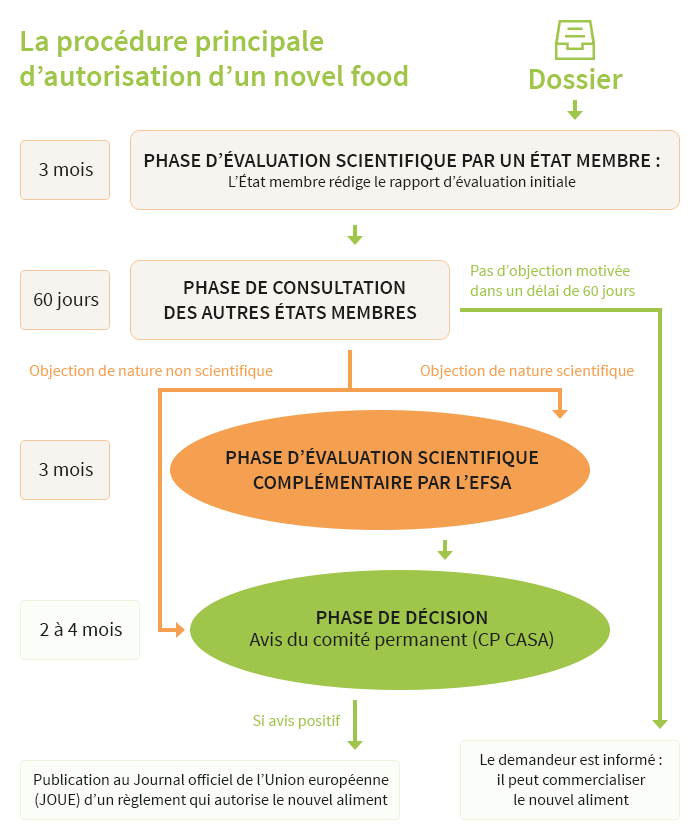
De 1997 à 2018, la procédure d'autorisation comportait plusieurs étapes :
- évaluation initiale par un Etat membre rapporteur qui donne son avis scientifique sur la sécurité sanitaire et la qualité nutritionnelle du novel food.
Lorsque la phase initiale d'évaluation par un Etat membre a lieu en France, c'est l'agence nationale de sécurité sanitaire (ANSES - ex AFSSA) qui réalise l'évaluation du dossier. - transmission du rapport aux autres Etats membres.
S'ils n'ont pas d'objections, alors le novel food peut être mis sur le marché, après réception d'une lettre d'autorisation transmise par l'Etat rapporteur. L'autorisation est valable pour tout le marché européen.
En cas d'objections :
- Une seconde évaluation réalisée par l'Autorité européenne de sécurité des aliments (EFSA).
- Phase de décision : les Etats membres arrêtent leur décision d'autoriser ou non le novel food. Ils décident des conditions d'utilisation.
- Autorisation délivrée par la Commission européenne, sous forme d'un règlement publié au Journal officiel.
De 1997 à 2018, quelle était la durée de la procédure d'autorisation ?
Avec l'ancien règlement "novel food", la procédure durait en moyenne 7 ans. Cela s'explique par le fait que dans 85% des cas il y avait une double évaluation. Dans la majorité des cas, les Etats membres émettaient des objections sur l'évaluation réalisée par le pays rapporteur. L'Autorité européenne de sécurité des aliments (EFSA) réalisait la seconde évaluation scientifique.
De 1997 à 2018, il existait une procédure simplifiée d'autorisation, appelée « notification »
Avec l'ancien règlement "novel food", la procédure simplifiée s'appliquait pour un novel food équivalent à un novel food déjà autorisé et appartenant à l'une des deux catégories :
- aliment et ingrédient composé de microorganismes, de champignons ou d'algues ou isolés à partir de ceux-ci.
- aliment et ingrédient composés de végétaux ou isolés à partir de ceux-ci et les ingrédients isolés à partir d'animaux.
De 1997 à 2018, comment fonctionnait la procédure simplifiée ?
Avec l'ancien règlement "novel food", dès lors qu'un producteur voulait commercialiser un novel food déjà autorisé, il devait effectuer une demande d'autorisation simplifiée. Il notifiait à la Commission européenne la mise sur le marché du novel food. Il fournissait les éléments démontrant l'équivalence en substance du produit avec le novel food déjà autorisé.
Chaque année, la Commission européenne publiait la liste des notifications de mise sur le marché qu'elle a reçues. Cela lui permettait d'avoir une bonne connaissance du marché.
Exemple : un premier jus de noni a reçu une autorisation accordée à l'entreprise X, selon la procédure d'autorisation principale. Ensuite d'autres producteurs de jus de noni ont déposé un dossier selon la procédure simplifiée, pour des produits équivalents en substance au jus de noni qui avait obtenu la 1ère autorisation.
Depuis le 1er janvier 2018, quelle est la procédure à suivre pour faire autoriser un novel food ?
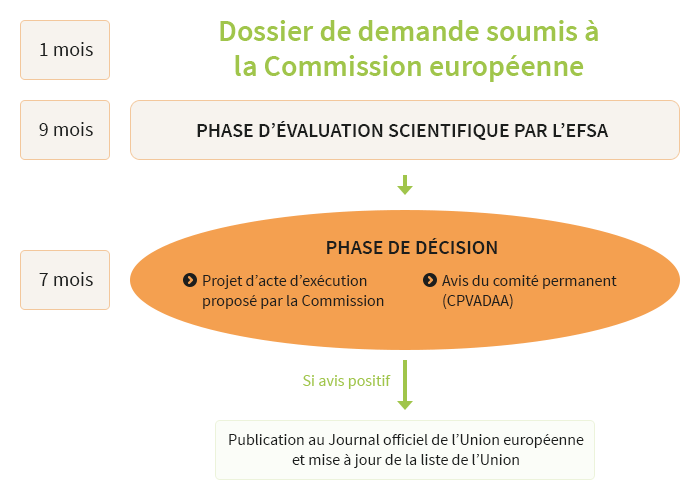
Depuis le 1er janvier 2018, le nouveau règlement "novel food" s'applique. La procédure d'autorisation est plus simple. Elle est centralisée directement à l'échelon européen. Elle comporte trois étapes :
- Phase d'évaluation : l'Autorité européenne de sécurité des aliments (EFSA) rend un avis sur la sécurité sanitaire et la qualité nutritionnelle du novel food.
- Phase de décision : la Commission européenne propose un projet d'acte d'exécution autorisant la commercialisation dans l'Union européenne du novel food. Les Etats membres décident d'autoriser ou non le novel food. Ils fixent les conditions d'utilisation.
- L'autorisation est officialisée par la Commission européenne, sous forme d'un acte d'exécution publié au Journal officiel.
A noter, pour les aliments traditionnels en provenance d'un pays-tiers, une procédure de notification est prévue. Seuls les aliments issus de la production primaire avec un historique d'utilisation sûre sont concernés.
Depuis le 1er janvier 2018, quelle est la durée de la procédure d'évaluation ?
Avec le nouveau règlement "novel food", la procédure devrait durer au moins 17 mois, à compter de la validation de la demande par la Commission européenne. S'ajoutera le temps nécessaire à l'adoption de l'acte d'exécution.
EVALUATION SCIENTIFIQUE
Comment est évaluée l'innocuité d'un novel food ?
En 2016, les lignes directrices publiées par l'Autorité européenne de sécurité des aliments (EFSA) ont remplacé les recommandations de la Commission européenne de 1997. Depuis le 1er janvier 2018, les dossiers doivent respecter les lignes directrices publiées par l'EFSA. Le pétitionnaire doit démontrer l'innocuité de son novel food. Il doit apporter des informations concernant :
- le procédé de fabrication
- la composition détaillée du nouvel aliment
- les preuves scientifiques démontrant que le nouvel aliment ne présente pas de risque en matière de sécurité pour la santé humaine
- s'il y a lieu, la ou les méthodes d'analyse
- les conditions d'utilisation prévue et les exigences spécifiques en matière d'étiquetage.
L'EFSA a également publié des lignes directrices spécifiques pour les aliments traditionnels en provenance de pays tiers.
HISTORIQUE DE L'EVOLUTION DE LA REGLEMENTATION NOVEL FOOD.
Pourquoi la réglementation « novel food » a-t-elle évolué en 2015 ?
En 1997, l'Europe harmonise les règles en matière de nouveaux aliments et se dote d'un règlement (n°258/97).
En 2006, la Commission européenne a mené une étude d'impact pour revoir la réglementation de 1997. Cette étude était attendue depuis 2003.
De 2008 à 2011, un projet de règlement a été discuté entre le Parlement européen et le Conseil. Les discussions se sont cristallisées sur le clonage et sur la répartition des rôles entre les députés et les Etats membres conduisant à l'échec d'un consensus en 2011.
Fin 2013, la Commission européenne a proposé un second projet de règlement.
Fin 2015, le règlement a été publié ( règlement 2015/2283). Il est entré en vigueur le 1er janvier 2018.
Il reprend les principales avancées du premier projet dont la procédure d'autorisation centralisée : l'évaluation scientifique du dossier se fait au niveau européen, par l'Autorité européenne de sécurité des aliments (EFSA).
Les autorisations sont désormais génériques.
Le concept d'équivalence disparait.
Une procédure de notification est établie pour les aliments traditionnels des pays tiers.
Le Parlement européen a introduit plusieurs dispositions pour protéger l'innovation, comme la protection des données.
Le Conseil a veillé à une continuité juridique : il a maintenu les catégories de novel food existantes, et a ajouté de nouvelles catégories pour tenir compte de l'évolution du marché (ex : insectes, ...).
